São catalisadores biológicos de origem proteica.
Macromoléculas com peso molecular entre 5.000 a 1.000.000 Da.
Algumas bebidas alcoólicas são derivadas de frutose e sacarose, neste caso, não há necessidade de uma etapa enzimática para converter o elemento em açúcar. Já o restante normalmente envolve amido, que consequentemente precisa ser degradado por ação enzimática antes de poder ser usado pela Saccharomyces cerevisiae. Isso normalmente acontecia por uma etapa adicional de fermentação anterior à fermentação alcoólica.
Estruturas proteicas
Primária
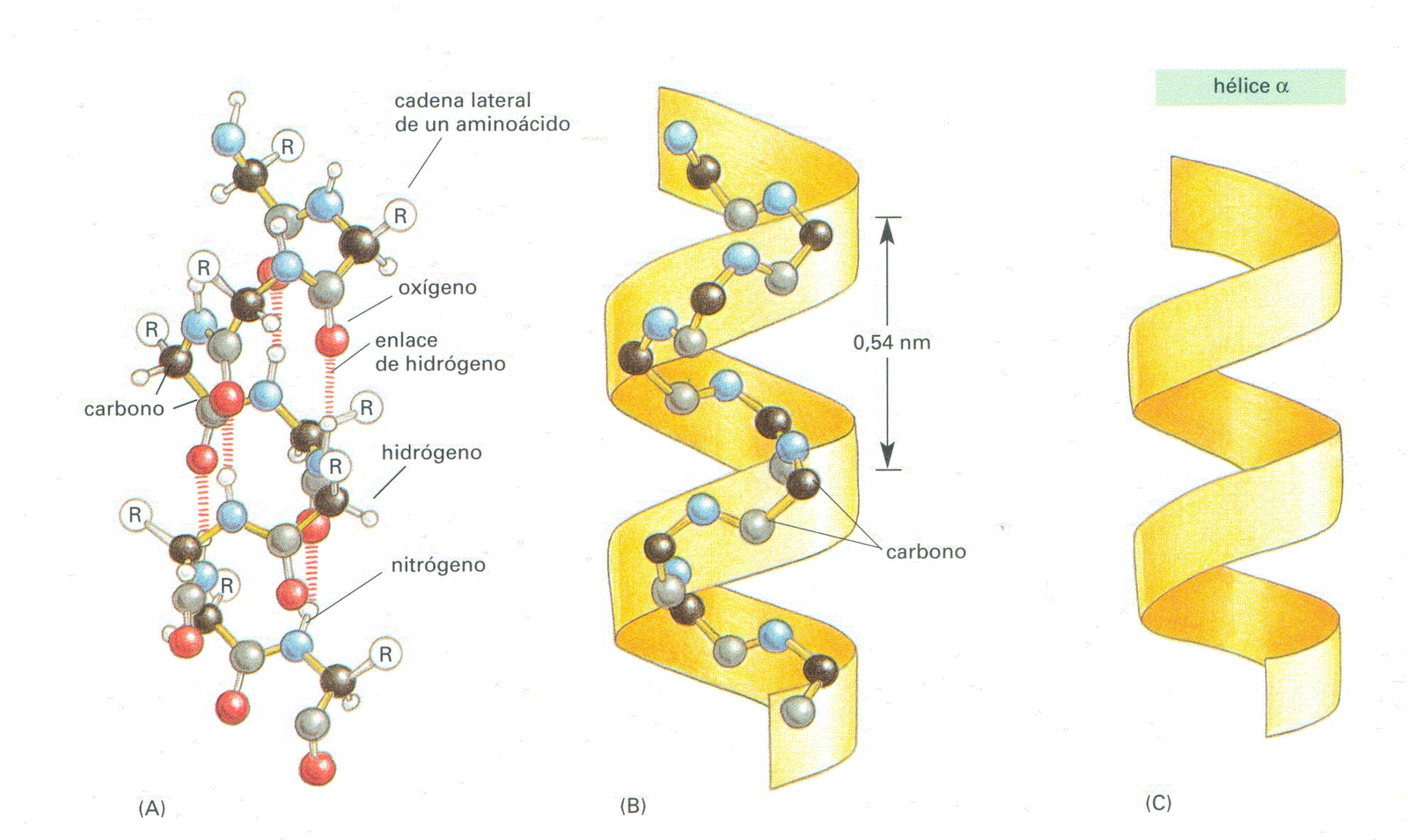
Secundária
Terciária
Ligações entre os Rs dos aminoácidos
Quaternária
Pontes de hidrogênio e ligações salinas.
Classes
- Classe 1 - Oxirredutases (catalisam reações de oxirredução);
- Classe 2 - Transferases (transferem grupos químicos entre moléculas);
- Classe 3 - Hidrolases (realizam a quebra química através da água);
- Classe 4 - Liases (formam ou destroem ligações duplas);
- Classe 5 - Isomerases (transformam uma molécula num isômero);
- Classe 6 - Ligases (formam ligações químicas por condensação);
- Classe 7 - Translocases (catalisam o movimento de íons e moléculas entre membranas).
Oxirredutases
Envolve transferência de elétrons (hidrogênio ou oxigênio). É obrigatório haver algo que está reduzindo e algo que está oxidando.
Transferases
Transferem grupos químicos de uma molécula para outra. Estes grupos podem incluir o grupo metilo, grupo fosfato, grupos acil, grupos de aminoácidos e muito mais. Por exemplo, as cinases são transferases que transferem grupos fosfato de ATP para outras moléculas.
Hidrolases
Estas enzimas catalisam reações de hidrólise, que envolvem a quebra de ligações químicas pela adição de uma molécula de água. Isto pode ser útil na digestão de alimentos, por exemplo, onde as hidrolases quebram grandes moléculas complexas em moléculas menores e mais simples.
Liases
As liases são enzimas que catalisam a formação ou destruição de ligações duplas por meio de adição ou remoção de grupos a partir de moléculas. Ao contrário das hidrolases, as liases não utilizam água para quebrar as ligações. As liases podem ser classificadas em vários subgrupos, dependendo do tipo de ligação que elas formam ou quebram.
Isomerases
Estas enzimas catalisam reações que transformam uma molécula em seu isômero. Isso significa que elas reorganizam a estrutura da molécula sem adicionar ou remover átomos. Isso pode ser útil, por exemplo, quando o corpo precisa converter uma molécula de um tipo para outro para cumprir uma determinada função.
Ligases
As ligases catalisam a formação de ligações químicas por condensação com a hidrólise de uma ligação de alta energia em uma molécula de ATP. São enzimas que facilitam a união de duas moléculas, utilizando a energia liberada pela quebra do ATP.
Translocases
Estas enzimas catalisam o movimento de íons e moléculas entre membranas. Isso é útil, por exemplo, para transportar íons através da membrana celular, um processo que é essencial para muitas funções celulares. As translocases são, portanto, uma classe importante de enzimas que ajudam a manter a homeostase celular.
Código de identificação
É como um IUPAC de enzimas. Envolve 4 números: W.X.Y.Z
W
É referente à classe.
X e Y
São referentes ao substrato.
Z
Relaciona-se ao identificador.
Definições
- Cofator inorgânicos: Ions metálicos.
- Cofator orgânico: Também conhecido como coenzima.
- Grupo prostético: Coenzima ou fator metálico ligado.
- Apoenzima ou apoproteína: parte proteica inativa, sem cofatores.
- Holoenzima: Junção de apoenzima e cofatores, constituindo a enzima completa e ativa.
Definições gerais
- Substrato: molécula sobre a qual a enzima atuará.
- Produto: resultado da reação.
- Sítio ativo/catalítico: porção física da enzima na qual ocorre a reação.
- Energia de ativação/barreira energética: quantidade de energia necessária para a reação ocorrer.
- Estado de transição/complexo ativado: fórmula molecular intermediária entre o reagente e o produto, existe somente no alto da barreira energética. É altamente instável.
Definições de enzima
As enzimas servem para reduzir a energia de ativação da reação, o que consequentemente aumenta sua velocidade. Ela não altera reação em sí, mas fornece um caminho alternativo que exige menor energia de reação.
Primeira definição
Chamado de chave-fechadura, criado por Emil Fisher.
O sítio ativo da enzima é fixo e tem a forma complementar à molécula do substrato, de forma que outras moléculas não tenham acesso.
Segunda definição
Modelo mão e luva, criado por Daniel Kosland.
O contato com a molécula do substrato induz mudanças conformacionais na enzima, que otimizam as interações com aminoácidos do sítio ativo.
Enzimas alostéricas
São aquelas que possuem sítios alostéricos, que permitem induzir ou reprimir a reação da enzima.
 [^imagem1]
[^imagem1]